Содержание
По химии, электроотрицательность это мера притяжения, которое атом оказывает на электроны в связи. Атом с высокой электроотрицательностью притягивает электроны с большой интенсивностью, в то время как атом с низкой электроотрицательностью будет делать это с небольшой интенсивностью. Эти значения используются для прогнозирования поведения различных атомов, когда они связаны друг с другом, что делает эту тему важным навыком в базовой химии.
меры
Метод 1 из 3: основные концепции электроотрицательности
Поймите, что химические связи возникают, когда атомы разделяют электроны. Чтобы понять электроотрицательность, важно сначала понять, что такое «связь». Говорят, что любые два атома в молекуле, «связанные» друг с другом на молекулярной диаграмме, имеют связь между собой. По сути, это означает, что они разделяют набор из двух электронов - каждый атом вносит атом в связь.
- Точные причины того, почему атомы разделяют электроны и соединяются вместе, не соответствуют теме этой статьи. Если вы хотите узнать больше, поищите в Интернете основные понятия о химических связях.

Понять, как электроотрицательность влияет на электроны, присутствующие в связи. Когда два атома совместно используют набор из двух электронов в связи, не всегда между ними существует равное распределение. Когда один из них имеет более высокую электроотрицательность, чем атом, к которому он присоединен, он приближает два электрона к себе. Атом с очень высокой электроотрицательностью может тянуть электроны на свою сторону в связи, почти отменяя обмен с другим.- Например, в молекуле NaCl (хлорида натрия) атом хлора имеет высокую электроотрицательность, а атом натрия - низкую электроотрицательность. Скоро электроны потянутся к хлору и вдали от натрия.

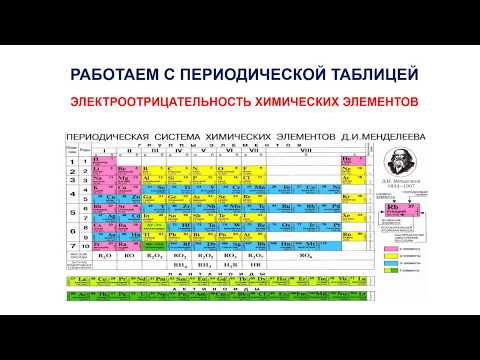
Для справки используйте таблицу электроотрицательности. В таблице электроотрицательности представлены элементы, расположенные точно так же, как в периодической таблице, но с каждым атомом, помеченным его электроотрицательностью. Их можно найти в нескольких учебниках химии, в технических статьях, а также в Интернете.- Вот отличная таблица электроотрицательности. Обратите внимание, что здесь используется шкала электроотрицательности Полинга, которая встречается чаще. Однако есть и другие способы измерения электроотрицательности, один из которых будет показан ниже.

Запомните тенденции электроотрицательности, чтобы легко делать оценки. Если у вас нет под рукой таблицы электроотрицательности, можно оценить это значение, исходя из вашего местоположения в периодической таблице. Как общее правило:- Электроотрицательность атома увеличивается когда вы переходите к право в периодической таблице.
- Электроотрицательность атома увеличивается когда вы переходите к вверх в периодической таблице.
- Следовательно, атомы в правом верхнем углу имеют самые высокие значения электроотрицательности, а атомы в нижнем левом углу - самые низкие.
- Например, в предыдущем примере с NaCl вы можете определить, что хлор имеет более высокую электроотрицательность, чем натрий, потому что он находится почти в верхней правой точке. С другой стороны, натрий находится далеко слева от таблицы, что делает его одним из наименее ценных атомов.
Метод 2 из 3: поиск связей с электроотрицательностью
Найдите разницу в электроотрицательности двух атомов. Когда два атома связаны вместе, разница между их значениями электроотрицательности многое говорит о качестве этой связи. Вычтите наименьшее значение из наибольшего, чтобы найти разницу.
- Например, если мы смотрим на молекулу HF, мы вычтем значение электроотрицательности водорода (2.1) из значения электроотрицательности фтора (4.0). 4,0 - 2,1 = 1,9.
Если разница меньше 0,5, связь ковалентная и неполярная. Здесь электроны делятся почти в равной степени. Эти связи не образуют молекул с большой разницей в заряде на обоих концах. Полярные связи часто очень трудно разорвать.
- Например, молекула O2 представляет этот тип подключения. Поскольку две молекулы кислорода имеют одинаковую электроотрицательность, разница между ними равна 0.
Если разница составляет от 0,5 до 1,6, связь ковалентная и полярная. Эти связи удерживают больше электронов на одном конце, чем на другом. Это делает молекулу немного более отрицательной в конце с большим количеством электронов и чуть более положительной в конце без них. Несбалансированность зарядов в этих связях позволяет молекулам участвовать в некоторых специфических реакциях.
- Хорошим примером этого является молекула H2О (вода). O является более электроотрицательным, чем два H, поэтому он удерживает электроны ближе и делает всю молекулу частично отрицательной на O-конце и частично положительной на H-концах.
Если разница больше 2, связь ионная. В этих связях электроны полностью расположены на одном конце. Самый электроотрицательный атом получает отрицательный заряд, а наименее электроотрицательный атом приобретает положительный заряд. Этот тип связи позволяет атомам реагировать с другими атомами или, кроме того, разделяться полярными атомами.
- Примером этого является NaCl (хлорид натрия). Хлор настолько электроотрицателен, что оттягивает оба электрона от связи друг к другу, оставляя натрий с положительным зарядом.
Если разница между 1,6 и 2, ищите металл. Если там металл, присутствующий в связке, это указывает на то, что это ионный, Если есть другие неметаллы, связь полярный ковалентный.
- Металлы включают большинство атомов слева и в центре периодической таблицы. На этой странице есть таблица, показывающая, какие элементы являются металлами.
- Наш предыдущий пример HF попадает в эту группу. Поскольку H и F не являются металлами, связь будет полярный ковалентный.
Метод 3 из 3: обнаружение электроотрицательности Малликена
Найдите первую энергию ионизации вашего атома. Электроотрицательность Малликена заключается в методе измерения, который немного отличается от метода измерения, приведенного в таблице Полинга выше. Чтобы найти его значение для данного атома, найдите свою первую энергию ионизации. Это энергия, необходимая для того, чтобы атом разрядил один электрон.
- Это значение, вероятно, можно найти в химических справочных материалах. На этой странице есть хорошая таблица, которую вы можете использовать (прокрутите вниз, чтобы найти ее).
- В качестве примера предположим, что вы хотите узнать, какова электроотрицательность лития (Li). В таблице на странице выше мы видим, что первая энергия ионизации эквивалентна 520 кДж / моль.
Узнайте, каково сродство атома к электрону. Это измерение энергии, получаемой при добавлении электрона к атому с образованием отрицательного иона. Опять же, это то, что следует найти в справочных материалах. На этой странице есть ресурсы, которые могут быть полезны.
- Электронное сродство лития равно 60 кДж моль.
Решите уравнение электроотрицательности Малликена. При использовании кДж / моль в качестве единицы энергии уравнение электроотрицательности Малликена можно записать как ENMulliken = (1,97 × 10) (Eя + Eи) + 0,19, Вставьте известные данные в уравнение и найдите значение ENMulliken.
- В нашем примере мы придем к следующему разрешению:
- ENMulliken = (1,97 × 10) (Eя + Eи) + 0,19
- ENMulliken = (1,97 × 10)(520 + 60) + 0,19
- ENMulliken = 1,143 + 0,19 = 1,333
- В нашем примере мы придем к следующему разрешению:
подсказки
- Помимо шкал Полинга и Малликена, существуют другие шкалы электроотрицательности, такие как Оллред-Рохоу, Сандерсон и Аллен. У каждого из них есть свои уравнения для расчета электроотрицательности (и некоторые из них могут быть довольно сложными).
- Электроотрицательность не имеет единицы измерения.